Yurchanka Siarhei/Shutterstock
De ziekte van Alzheimer en andere vormen van dementie treffen wereldwijd meer dan 55 miljoen mensen. Maar de ontwikkeling van effectieve behandelingen en geneeswijzen vordert langzaam. Tot op zekere hoogte komt dit omdat we nog steeds niet genoeg begrijpen wat de ziekte veroorzaakt en de progressie ervan stimuleert.
Het meest recente werk van mijzelf en mijn collega’s, gepubliceerd in Science Innovations, presenteert een nieuwe benadering waarbij ideeën uit andere wetenschapsgebieden worden gebruikt om gegevens van Alzheimerpatiënten te analyseren. Op deze manier hebben we een beter begrip kunnen opbouwen van de processen die de progressie van de ziekte van Alzheimer in de hersenen beheersen.
Bij wijze van achtergrond, bij de ziekte van Alzheimer en vele andere neurodegeneratieve ziekten, zoals de ziekte van Parkinson, beginnen eiwitten die normaal gesproken deel uitmaken van gezonde hersencellen aan elkaar te kleven in microscopisch kleine klontjes. Deze eiwitklontjes, aggregaten genaamd, vormen zich in de hersenen van patiënten, waarbij hersencellen worden gedood en symptomen zoals geheugenverlies optreden.
Naarmate het aantal aggregaten toeneemt, verergert de ziekte en leidt uiteindelijk tot de dood, vaak vele jaren na de eerste milde symptomen. Verschillende processen dragen waarschijnlijk bij aan de vorming van aggregaten, maar wetenschappers moeten nog begrijpen hoe aggregaten zich in element vormen en welke processen het belangrijkst zijn om te bepalen hoe snel ze zich vormen.
Lees meer: Alzheimer: nieuw onderzoek toont een sprong voorwaarts in het identificeren van neuronen die kwetsbaar zijn voor de ziekte

Ons onderzoek werpt licht op het verloop van de ziekte van Alzheimer in de hersenen.
tonkid/Shutterstock
Bij het onderzoek naar de ziekte van Alzheimer worden vaak proefdieren, zoals muizen, gebruikt om de ziekte bij de mens na te bootsen. Deze benadering kan zeer nuttig zijn om specifieke aspecten van de ziekte te onderzoeken, zoals het effect van genetische factoren. Maar het is geen geweldig design voor de ziekte als geheel. Dit komt deels omdat de ontwikkeling van de ziekte van Alzheimer bij mensen normaal gesproken tientallen jaren duurt, en proefdieren kunnen alleen in excess of een veel kortere tijdspanne worden bestudeerd.
We hadden een manier nodig om de progressie van de ziekte van Alzheimer in de hersenen te begrijpen satisfied behulp van gegevens rechtstreeks van mensen. Tot nu toe was dit moeilijk, in de eerste plaats omdat de gegevens van mensen veel beperkter zijn dan wat we kunnen verkrijgen bij proefdieren (we kunnen proefdieren aanpassen, maar mensen niet). Het was ook lastig omdat de wiskundige modellen om verschillende soorten menselijke gegevens die related zijn in deze context te combineren en analyseren, niet bestonden.
Dit is waar ons werk om de hoek komt kijken. Met behulp van een benadering uit de fysische chemie, genaamd chemische kinetiek, waren we in staat om uit te zoeken wat er op microscopisch niveau in de hersenen van Alzheimer gebeurt. Chemische kinetiek stelt ons in staat te begrijpen hoe moleculen achieved elkaar interageren, en hoe snel, zonder dat we hoeven in te zoomen en op moleculair niveau te kijken.
We kunnen bijvoorbeeld uitzoeken hoe bleekmiddel gekleurde moleculen vernietigt door simpelweg te kijken hoe snel een vlek verdwijnt wanneer bleekmiddel wordt aangebracht. Bij de ziekte van Alzheimer is het veel complexer, maar we hebben dezelfde ideeën kunnen toepassen om te bepalen hoe aggregaten zich vormen in de hersenen van Alzheimer.
Al meer dan tien jaar gebruiken we chemische kinetiek in steeds complexere systemen, te beginnen in een reageerbuis. Onze nieuwe studie is de eerste keer dat we deze methoden hebben kunnen toepassen op menselijke gegevens, zoals van PET-scans bij patiënten satisfied de ziekte van Alzheimer, hersenmicroscopie van patiënten die aan de ziekte zijn overleden, en andere meettechnieken.
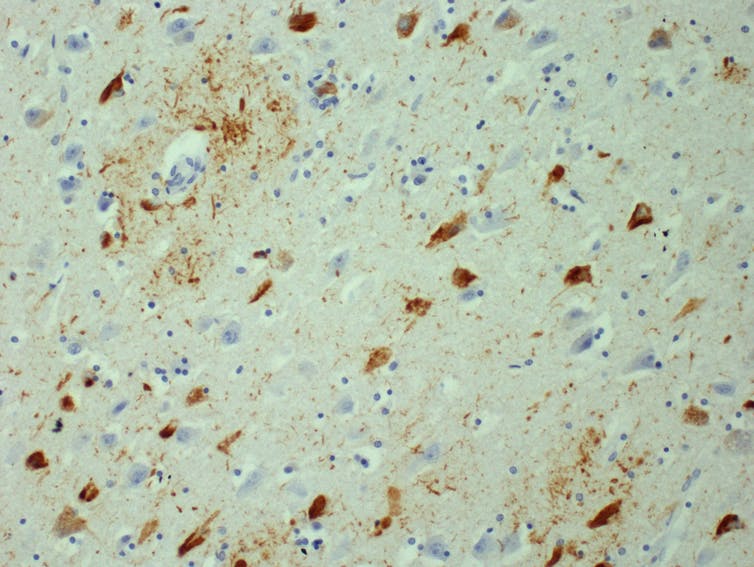
Deze afbeelding toont tau-aggregaten (bruin) en hersencellen (blauw) in een brein dat is aangetast doorway de ziekte van Alzheimer.
Dr. Kieren Allinson/Universiteit van Cambridge, Auteur verstrekt
De resultaten
We ontdekten dat de eiwitaggregaten in de hersenen van patiënten met de ziekte van Alzheimer zich exponentieel vermenigvuldigen, wat betekent dat één aggregaat na een bepaalde tijd twee aggregaten produceert, die vervolgens, nadat dezelfde hoeveelheid tijd is verstreken, vier aggregaten produceert, enzovoort.
Zoals we allemaal hebben meegemaakt tijdens de COVID-pandemie, kan exponentiële groei in het start out bedrieglijk traag lijken en vervolgens resulteren in een schijnbaar plotselinge toename. Bij de ziekte van Alzheimer verklaart dit waarom patiënten geen symptomen of milde symptomen ervaren, terwijl de aggregaten zich aanvankelijk opbouwen, gevolgd door een veel snellere progressie en verergering van de symptomen.
Een bemoedigende bevinding uit ons werk is dat het menselijk brein eigenlijk very best goed is in het vertragen van de vermenigvuldiging van aggregaten. We ontdekten dat het ongeveer vijf jaar duurt om de hoeveelheid aggregaten te verdubbelen, wat meer dan tien keer langer is dan bij proefdieren of de reageerbuis. De reden hiervoor heeft waarschijnlijk te maken achieved veel factoren, zoals de aanwezigheid van moleculen die verschillende aggregatiestappen in de hersenen vertragen. Het maakt allemaal deel uit van ons lopende onderzoek.
Lees meer: Wordt Alzheimer veroorzaakt door verstoringen van de energievoorziening van de hersenen?
Een ander proces waarin wetenschappers erg geïnteresseerd zijn, is de verspreiding van aggregaten van het ene hersengebied naar het andere. We hebben ook onderzocht hoe belangrijk dit proces is bij het aanjagen van de ziekteprogressie en ontdekten, verrassend genoeg, dat het weinig effect lijkt te hebben op de snelheid van progressie. Hoewel spreiding de locatie van de initiële aggregaten tot op zekere hoogte kan beïnvloeden, ontdekten we dat de belangrijkste element die de snelheid van progressie regelt, de vermenigvuldiging van aggregaten in individuele hersengebieden is.
Hier kunnen we around nadenken doorway terug te keren naar COVID-19. Het stoppen van reizen tussen landen is geen bijzonder effectieve manier om gevallen te stoppen wanneer er al aanzienlijke aantallen geïnfecteerde mensen in het oorspronkelijke land zijn. We ontdekten dat, op dezelfde manier, het stoppen van de verspreiding van aggregaten tussen hersengebieden waarschijnlijk niet zal helpen om de ziekte van Alzheimer te vertragen als het eenmaal is begonnen.
Het richten op de vermenigvuldiging van aggregaten in individuele hersengebieden is waarschijnlijk een veelbelovende strategie. Op een dag kunnen we deze benadering misschien gebruiken om de ziekte te vertragen en patiënten nog een aantal jaren van gezond leven te geven.
![]()
Georg Meisl ontvangt financiering van de ERC en Sidney Sussex School Cambridge om dit onderzoek uit te voeren.